Chez les bactéries, ces proies qui deviennent les prédateurs… de leurs prédateurs
Si on vous parle de prédation, vous pensez certainement à un lion qui pourchasse une gazelle ou à un lynx bondissant sur un lièvre dans la neige. Mais savez-vous que certaines bactéries aussi tuent et se nourrissent de leurs proies ? Dans un article publié aujourd’hui dans la revue scientifique Plos Biology, nous expliquons comment nous avons observé que, chez les bactéries, les proies peuvent devenir les prédateurs… de leurs prédateurs, comme si la gazelle se mettait à chasser le lion.
Marie Vasse, Université de Montpellier
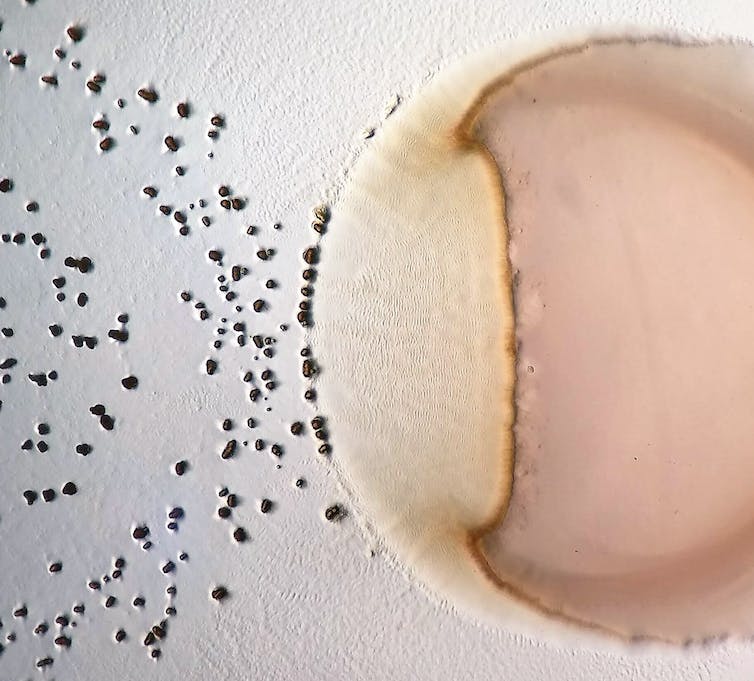
Le monde tel que nous le connaissons abrite une multitude d’autres mondes, moins facilement accessibles, notamment parce qu’invisibles à l’œil nu. Je m’intéresse à ces mondes microscopiques et aux organismes qui les habitent. J’étudie comment ces microorganismes interagissent, comment ils coopèrent pour accéder à des ressources par exemple, comment ils se battent, comment ils communiquent et même comment ils se tuent et se mangent entre eux. Entre 2019 et 2021 à l’École polytechnique fédérale de Zurich (ETH), des collègues et moi avons mené un projet en laboratoire pour faire évoluer des communautés de bactéries et tenter de comprendre comment leurs interactions se modifient au cours des générations.
Des résultats étranges…
En 2021, après avoir réalisé deux fois une des expériences du projet, j’ai quitté l’ETH pour rejoindre le CNRS et j’ai laissé à une de mes collègues le soin de répéter deux nouvelles fois l’expérience en question. Quand on fait de la recherche, une des manières de valider des observations est de répéter une expérience pour s’assurer que les résultats ne changent pas entre les répétitions. Sauf que cette fois-ci, les résultats n’étaient pas seulement un peu différents, ils étaient complètement inversés !
L’expérience consistait à mettre en présence une bactérie décrite comme prédatrice et une bactérie décrite comme proie pour estimer l’efficacité de la prédation. Au cours des deux premières répétitions, mais aussi dans les expériences précédentes que nous avions menées avec ces deux espèces bactériennes, Myxococcus xanthus tuait et se nourrissait de Pseudomonas fluorescens. Il était donc clair que M. xanthus était le prédateur et P. fluorescens la proie. Lors de la troisième répétition, ma collègue a non seulement observé que P. fluorescens était en pleine expansion mais aussi que M. xanthus avait complètement disparu des boîtes en plastique (appelées boîtes de Petri et qui contiennent les milieux de culture) dans lesquelles nous faisions les expériences.
Après de nombreuses interrogations et de longues discussions, nous avons compris que la différence entre sa manière de conduire l’expérience et la mienne était qu’elle laissait les boîtes dans lesquelles poussait P. fluorescens sur la paillasse du laboratoire, et donc à température ambiante, au lieu de les incuber à 32 °C comme M. xanthus, par manque de place dans l’incubateur. Il faut savoir que les deux espèces ne poussent pas à la même vitesse et qu’avant d’étudier leurs interactions il faut donc les faire grandir indépendamment.
Nous étions vraiment surpris et avions très envie d’en savoir davantage. Nous avons donc formulé une nouvelle question de recherche, à savoir : la température à laquelle poussent ces bactéries peut-elle déterminer qui est la proie et qui est le prédateur ? Nous avons commencé par vérifier que le facteur déterminant était effectivement la température en faisant pousser P. fluorescens à 22 °C et 32 °C, avant de la mettre en contact avec l’autre espèce à 32 °C, et nous avons estimé le nombre de M. xanthus présentes après interaction.
L’ancienne proie tue et se nourrit de son prédateur !
Lorsque P. fluorescens avait poussé à 32 °C, nous retrouvions plusieurs millions de M. xanthus dans les boîtes ; mais lorsqu’elle avait poussé à 22 °C, nous ne pouvions détecter aucune cellule vivante de cette espèce ! Ces résultats en conditions de températures contrôlées corroboraient nos observations précédentes : la « proie » pouvait exterminer son « prédateur ». Il faut noter, cependant, que pour être un prédateur, il ne suffit pas de tuer, il faut aussi pouvoir se nourrir de sa proie. Comme il est difficile d’observer une bactérie prenant son déjeuner, nous avons évalué la capacité du microbe à en manger un autre en mesurant les effets de l’interaction sur la taille des populations : si P. fluorescens tue et se nourrit de M. xanthus, on s’attend à voir moins de M. xanthus vivantes et plus de P. fluorescens, ces dernières ayant pu se reproduire grâce aux nutriments issus de la prédation.
Nous avons donc réalisé une nouvelle expérience dans laquelle nous faisions pousser P. fluorescens à 22 °C et 32 °C puis nous ajoutions soit M. xanthus dans une solution saline, soit la solution saline seule. À 32 °C, la présence de M. xanthus réduisait beaucoup le nombre de P. fluorescens en mangeant ces bactéries. À 22 °C en revanche, M. xanthus était exterminée par P. fluorescens et on trouvait en moyenne deux fois plus de P. fluorescens qu’en présence de la seule solution saline : la relation prédateur-proie était inversée et l’ancienne proie tuait et se nourrissait de son prédateur !
Nous avons ensuite tenté de comprendre comment P. fluorescens devenait le prédateur. En faisant pousser cette espèce dans un milieu liquide, nous avons compris qu’à 22 °C, mais pas 32 °C, elle produisait une (ou plusieurs) molécule(s) et les sécrétait dans l’environnement. C’est cette molécule sécrétée qui extermine M. xanthus.
Dans notre étude, P. fluorescens produit la molécule qui sert la prédation avant même d’interagir avec l’autre bactérie. C’est donc certainement qu’à 22 °C, P. fluorescens utilise cette molécule à des fins que nous ignorons et que cette molécule a comme effet secondaire de tuer M. xanthus.
Enfin, nous avons voulu savoir si cette molécule pouvait tuer d’autres bactéries ou si elle était spécifique. Nous avons donc exposé sept autres espèces bactériennes aux sécrétions de P. fluorescens qui avait poussé à 22 °C. Aucune autre espèce de bactérie n’était totalement exterminée comme M. xanthus, mais, en présence des sécrétions de P. fluorescens, le nombre de Bacillus bataviensis était réduit de 10 % en moyenne et celui de Micrococcus luteus de 50 %. M. xanthus n’est donc pas la seule bactérie pouvant être tuée par P. fluorescens quand celle-ci a poussé à 22 °C.
Nous ne connaissons pas encore exactement la nature de cette molécule de P. fluorescens qui lui permet d’agir en prédateur de M. xanthus. D’autres expériences seront nécessaires pour le découvrir, elles sont en cours. Ce qu’indique notre étude cependant, c’est que, contrairement au lion et à la gazelle (qui a déjà vu une gazelle dévorer un lion ?), modifier un seul paramètre dans les conditions de croissance des bactéries peut avoir des conséquences radicales sur leurs rôles dans les interactions. Si des bactéries qui n’ont jamais été décrites comme prédatrices peuvent éradiquer leur prédateur seulement en poussant dans un milieu un peu plus froid, il est fort probable que de nombreuses interactions proies-prédateurs entre bactéries nous échappent. Une autre conséquence de cette étude est que l’on peut difficilement ranger les bactéries dans des cases comme proies ou prédateurs. Au contraire, c’est en s’intéressant à leurs interactions qu’on pourra en apprendre davantage sur le fonctionnement de ces mondes microscopiques si fascinants !
Marie Vasse, Chercheuse en biologie évolutive, Université de Montpellier
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.