Pourquoi il y a peu de chances pour que le coronavirus SARS-CoV-2 perde sa virulence
Depuis le début de la pandémie de Covid-19, des avis bien arrêtés sont régulièrement émis sur l’évolution de la virulence du SARS-CoV-2. Pour beaucoup, elle devrait forcément diminuer puisque « de tous temps » virus, bactéries et autres parasites auraient perdu de leur virulence en s’adaptant à leurs hôtes.
Samuel Alizon, Institut de recherche pour le développement (IRD) et Mircea T. Sofonea, Université de Montpellier

Malheureusement, cette « intuition » ne résiste pas à l’analyse, car elle nécessite de voir le virus de l’immunodéficience humaine (VIH), le bacille de la tuberculose, l’hématozoaire du paludisme ou encore la grippe comme des exceptions. En fait, on a beau chercher, difficile de trouver des « parasites » (pour utiliser un terme de biologie de l’évolution) qui se conforment à cet axiome, baptisé « loi de la virulence décroissante » au début du XXème siècle.
Pourquoi alors cette vision persiste-t-elle ? Que nous apprennent les découvertes récentes de la biologie de l’évolution à propos de la virulence ? Et à quoi s’attendre dans le cas du SARS-CoV-2 ?
Ne pas confondre létalité et virulence
La logique qui sous-tend la théorie d’une évolution systématique des parasites vers un état dénué de virulence (avirulent) est d’une simplicité enfantine : pour le parasite, tuer son hôte c’est tuer la poule aux œufs d’or. Autrement dit, les souches (ou « variants » pour reprendre un qualificatif plus en vogue) qui tuent leur hôte rapidement devraient avoir moins de succès que les autres, et donc disparaître.
Une explication au fait que cette théorie centenaire soit toujours aussi prégnante est la confusion entre les notions de létalité et de virulence.
La létalité est la proportion d’individus infectés qui décèdent suite à l’infection par un parasite donné, dans un endroit donné, à une époque donnée. De nombreux éléments contribuent à diminuer la létalité apparente : traitements, vaccination, qualité de la prise en charge clinique, etc. La virulence, elle, correspond à la propension du parasite à nuire à son hôte. Elle se quantifie en l’absence de soins spécifiques.
Autrement dit, le même variant viral aura une létalité différente d’un pays à un autre suivant par exemple la qualité du système hospitalier. En revanche, sa virulence sera inchangée.
Dans le cas du SARS-CoV-2, on a assisté à une baisse de la létalité depuis le début de l’épidémie dans beaucoup de pays, en grande partie grâce à la vaccination. En revanche, la virulence a augmenté. Les infections par le variant Alpha causent plus souvent des décès que celles impliquant les lignées ancestrales qui circulaient début 2020. Quant au variant Delta, les premiers résultats semblent indiquer qu’il est plus virulent que le variant Alpha, car il entraînerait davantage d’hospitalisations chez les personnes non vaccinées. Des résultats préliminaires vont dans le même sens pour le variant Bêta.
Reconnaissons que ceci est contre-intuitif. Mais c’est aussi l’illustration que la biologie de l’évolution est une discipline à part entière, et qu’il est hasardeux de s’en autoproclamer expert. Or, beaucoup la considèrent plutôt comme une sorte de « hobby », que l’on pratiquerait après avoir acquis suffisamment d’expérience sur des sujets plus proximaux, tels que les mécanismes du développement ou de la physiologie des organismes. C’est probablement une autre raison de la persistance des idées reçues sur l’évolution de la virulence.
La biologie de l’évolution a-t-elle vraiment plus à apporter que les intuitions de « vieux sages » ? Évidemment, ce domaine de recherche souffre du fait que l’on ne peut pas reproduire une épidémie à l’identique. Toutefois, l’analyse d’épidémies antérieures à celle que nous vivons actuellement (notamment celle de VIH) et des études d’évolution dite « expérimentales », conduites sur d’autres parasites, sont riches d’enseignements.
Deux sortes de virulence
Pour commencer, il faut distinguer deux catégories parmi les dégâts infligés par un parasite à son hôte, selon qu’ils influencent ou non la propagation dudit parasite : la virulence non adaptative et la virulence adaptative.
La virulence non adaptative ne bénéficie à aucune des deux parties. Dans le cas du SARS-CoV-2, on peut y ranger des manifestations particulièrement sévères de l’infection, telles que les orages cytokiniques. La seconde catégorie de virulence est dite « adaptative », car elle est associée à une meilleure propagation du parasite, directement ou indirectement.
Seth Pincus, Elizabeth Fischer et Austin Athman, National Institute of Allergy and Infectious Diseases / NIH
Dans le cas du VIH, par exemple, il a été montré que les variants plus virulents – ceux qui produisent le plus de particules virales en exploitant plus efficacement les cellules de leur hôte ou échappant mieux à la réponse immunitaire – étaient aussi plus contagieux, car la probabilité de transmission est liée à la quantité de virus dans le sang.
Distinguer les composantes non adaptatives et adaptatives de la virulence permet de mieux raisonner sur l’évolution de ce trait. On s’attend en général à ce que la virulence non adaptative diminue, puisqu’elle n’est associée qu’à des coûts. Toutefois, ce n’est pas si simple, car il faut tenir compte du cycle de vie du parasite.
Dans le cas du SARS-CoV-2, les symptômes sévères apparaissent en général après 2 semaines d’infection, or plus de 95 % des transmissions ont lieu avant le 11e jour. Autrement dit, du point de vue de ce coronavirus, les manifestations pathologiques tardives (en particulier inflammatoires) de la virulence ne constituent pas une perte d’opportunités de transmission. Par conséquent, il est malheureusement improbable que la sélection naturelle favorise des variants causant moins souvent de telles manifestations immunopathologiques.
Au niveau de la composante adaptative de la virulence, les prévisions sont encore moins simples. Tout dépend de la relation entre les coûts (la virulence) et les bénéfices pour la propagation du virus (taux de transmission, durée de l’infection). Dans le cas du VIH là encore, il a été montré qu’un niveau de virulence intermédiaire maximise la valeur sélective du virus, c’est-à-dire le nombre d’infections engendrées par une personne porteuse du virus.
Un élément qui pourrait nous faire penser qu’il existe une telle corrélation entre virulence et transmission dans le cas du SARS-CoV-2 est que les variants plus transmissibles sont aussi plus virulents.
Notre équipe a par exemple montré qu’en France le variant Alpha avait un net avantage de transmission par rapport aux lignées ancestrales. Nos confrères britanniques ont de leur côté conclu que sa virulence avait augmenté de 50 %. De même, nous avons montré au mois de juin 2021 que le variant Delta était lui plus contagieux que le variant Alpha. Selon cette logique, un variant plus transmissible pourrait donc être encore plus virulent.
À quoi peut-on s’attendre ?
Le fait que les variants plus contagieux soient plus virulents laisse à penser que la composante adaptative de la virulence n’est pas nulle.
La difficulté pour anticiper l’évolution virale est qu’il faut savoir à quel point le virus, donc le variant Delta, est maintenant adapté à nous. Ce coronavirus a-t-il encore de la marge pour exploiter son hôte humain plus efficacement (autrement dit, pour ce niveau de contagiosité, pourrait-il être moins virulent) ? Ou bien au contraire, est-ce que toute baisse de virulence se traduirait aussi par une baisse de contagiosité ?
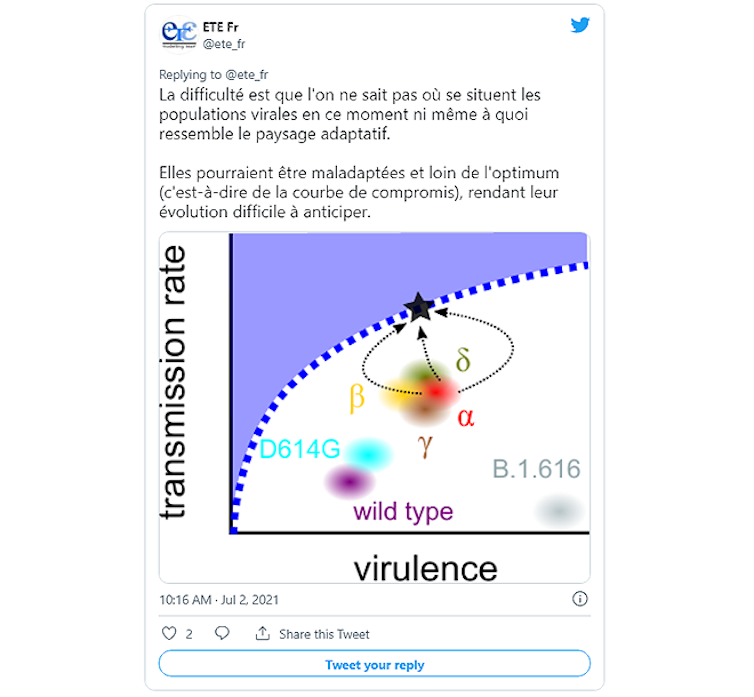
@ete_fr – July 2, 2021
Dans le premier cas, s’il reste au virus une certaine marge de manœuvre pour mieux s’adapter à son hôte, il est quasiment impossible d’anticiper la prochaine étape de son évolution. Des expériences de mutagenèse pourraient néanmoins aider à savoir quelles sont les formes virales les plus stables. Précisons que ces générations de mutants en laboratoire se font de manière sécurisée (par exemple on ne travaillera que sur une protéine virale donnée).
De tels travaux dits de « criblage de mutations profond » ont été réalisés sur une partie du gène servant à fabriquer la protéine S du virus (celle contenant les informations concernant la partie de la protéine appelée receptor binding domain, RBD), qui lui sert de « clé » pour entrer dans nos cellules. Ils consistent à générer toutes les mutations possibles dans le RBD puis à étudier leur effet sur la production des protéines S résultantes, et leur capacité à se lier au récepteur ACE2 situé à la surface des cellules (récepteur qui sert de point d’entrée au virus). Ces travaux ont permis de repérer des sites particulièrement à risque en termes d’évolution de variants.
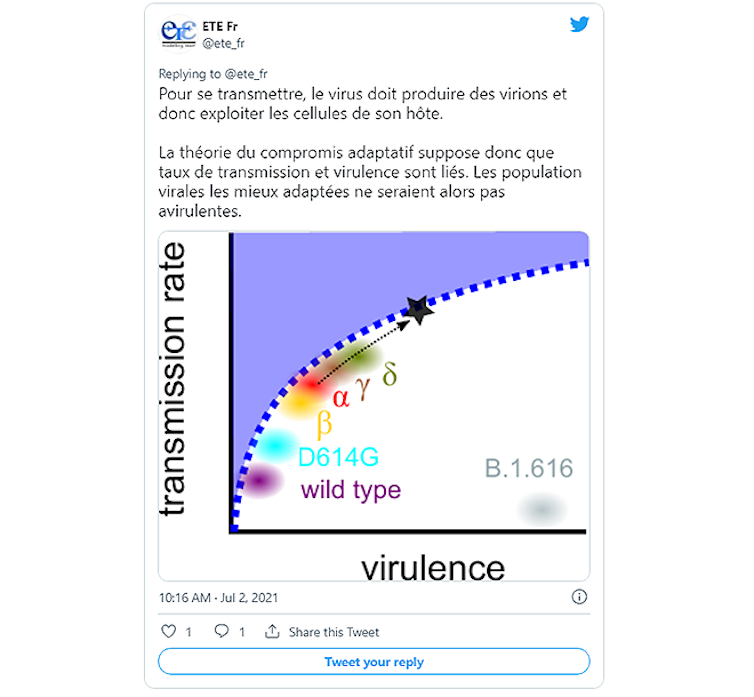
@ete_fr – July 2, 2021
Dans le second cas, on pourrait s’attendre à ce que la virulence se stabilise autour d’une valeur maximisant le nombre d’infections secondaires, donc une optimisation entre taux de transmission et virulence. La prévoir nécessiterait de connaître exactement les contraintes entre ces deux traits de l’infection. Mais, là encore, ce n’est pas la fin de l’histoire.
Les effets de l’immunisation
L’immunisation des populations (naturelle ou par la vaccination) bouleverse le paysage adaptatif des virus : le variant le plus adapté dans une population non protégée peut se retrouver minoritaire dans une population immunisée. Le Brésil l’a vécu de manière tragique, puisqu’ayant construit une immunité de groupe au prix d’une catastrophe sanitaire majeure, il a quand même été victime d’une deuxième vague due au variant Gamma – dont on pense qu’il a envahi rapidement le pays car en partie capable d’échapper à l’immunité conférée par les souches ancestrales.
NIAID / NIH
À court terme, la vaccination est essentielle : comme l’immunité naturelle, elle diminue la létalité de l’infection, accélérant la transition vers une dynamique proche de celle des virus respiratoires saisonniers. En effet, il y un an, personne n’aurait osé espérer une telle efficacité vaccinale contre la survenue de formes sévères (même pour le variant Delta, on estime que cette protection est de l’ordre de 85 %). Cette efficacité fait d’autant plus ressortir les inégalités vaccinales : pour celles et ceux qui n’auront pas la chance d’avoir accès au vaccin, la létalité des infections est déjà plus élevée qu’en 2020 et pourrait encore augmenter avec l’évolution de futurs variants.
Réconcilier Pasteur et Darwin
Au-delà du sentiment d’urgence qui résulte de la situation sanitaire, il est important d’envisager la pandémie sur le moyen et le long terme. Les prévisions sont très délicates à réaliser, car les relations entre le virus et notre système immunitaire s’inscrivent dans un contexte co-évolutif : les virus mutent et nos réponses immunitaires changent. Pour essayer d’anticiper l’avenir, il faut notamment tenir compte des efficacités et durées des immunités naturelles et vaccinales, qui diminuent la vitesse d’évolution des populations virales : moins d’infections signifie moins de mutations…
L’étude de ces relations dynamiques et de leurs implications est l’objet de la biologie de l’évolution. Malheureusement, en plus du manque de financement chronique de la recherche scientifique en France, cette discipline souffre d’un manque de reconnaissance et les connaissances disponibles sont trop rarement mises à profit. Un exemple parmi d’autres : malgré l’effort consenti pour inclure diverses facettes de la recherche sur le SARS-CoV-2 au sein du conseil scientifique, celui-ci ne compte en son sein aucun⋅e biologiste de l’évolution.
Confier l’anticipation des tendances évolutives des pathogènes aux intuitions d’une « sagesse traditionnelle », ignorante des découvertes et outils les plus récents de la biologie de l’évolution, c’est avancer les yeux fermés. En matière de maladies infectieuses, ceci peut avoir des conséquences particulièrement graves étant donné la vitesse avec laquelle évoluent et se propagent les microbes. En santé publique, il est urgent de réconcilier Louis Pasteur et Charles Darwin.
Pour en savoir plus :
– Alizon, S. & Sofonea, M. T. (2021) SARS-CoV-2 virulence evolution : Avirulence theory, immunity and trade-offs. Journal of Evolutionary Biology
– Alizon S. (2020) Pandémies, Écologie et Évolution, éditions Points![]()
Samuel Alizon, Directeur de Recherche au CNRS, Institut de recherche pour le développement (IRD) et Mircea T. Sofonea, Maître de conférences en épidémiologie et évolution des maladies infectieuses, laboratoire MIVEGEC, Université de Montpellier
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.